Pipéroxane
| Pipéroxane | |
| |
| Identification | |
|---|---|
| Nom UICPA | 1-(2,3-dihydro-1,4-benzodioxine-2-ylméthyl)pipéridine |
| Synonymes |
933 F, Bénodaïne |
| No CAS | |
| Code ATC | |
| PubChem | 6040 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
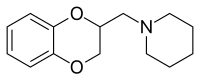
| Formule | C14H19NO2 [Isomères] |
| Masse molaire[1] | 233,306 2 ± 0,013 3 g/mol C 72,07 %, H 8,21 %, N 6 %, O 13,72 %, 233.31 g/mol |
| Écotoxicologie | |
| DL50 | 175 mg·kg-1 (Souris, i.p.)[2] 35 mg·kg-1 (Lapin, i.v.)[2] |
| Considérations thérapeutiques | |
| Classe thérapeutique | Alpha-bloquant Antihistaminique |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le pipéroxane est le premier médicament antihistaminique jamais découvert.
Stéréochimie
[modifier | modifier le code]Le pipéroxane possède un atome de carbone chiral, le carbone 2 en α d'un oxygène et en connexion avec le méthylène qui porte aussi la pipéridine. Le pipéroxane se présente donc sous la forme d'une paire d'énantiomères : le (2R)-pipéroxane et le (2S)-pipéroxane.
Histoire
[modifier | modifier le code]La découverte
[modifier | modifier le code]Dérivé du benzodioxane, le pipéroxane est synthétisé au début des années 1930 à l’Institut Pasteur sous le nom de 933 F par Ernest Fourneau[3], qui l’étudie d’abord comme α-bloquant des récepteurs de l’adrénaline. En 1933, Fourneau et Daniel Bovet démontrent qu’il agit également, chez le cochon d’Inde, comme antagoniste du spasme bronchique induit par l’histamine[4],[5] et, en 1937, Bovet et Anne-Marie Staub décrivent l’action antihistaminique du 1571 F, un dérivé du diaminéthylène[6],[7]. C'est, entre autres, pour ces contributions que Daniel Bovet obtiendra le prix Nobel en 1957.
Les prolongements
[modifier | modifier le code]En remplaçant par NH ou par NR l’oxygène des molécules d’abord étudiées, Anne-Marie Staub donne dans sa thèse de 1939 une première extension aux substances douées d’activité antihistaminique[8]. À partir des découvertes exposées dans cette thèse, de nombreux corps diaminés sont préparés par Jean-Pierre Fourneau, le fils d’Ernest, et Yvonne de Lestrange dans le laboratoire de chimie thérapeutique de l'Institut Pasteur[9].
Mais à cause de leur toxicité, ces substances aux résultats physiologiques pourtant remarquables restent trop peu maniables. Les études sont donc poursuivies à partir de la molécule initiale, le 1571 F, tant chez Rhône-Poulenc qu’à l’étranger où un palier très important est encore franchi en 1948 par les Américains Tilford, Shelton et van Campen[10], qui décrivent des molécules dont certaines protègent contre jusqu’à trois cents doses mortelles d’histamine introduites par voie intraveineuse.
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Pipéroxane », sur ChemIDplus, consulté le 2 décembre 2010
- Yves Cohen, Pharmacologie, Masson et Cie, coll. « Abrégés de pharmacie », , 6e éd., p. 249.
- « Recherches sur l’action sympathicolytique de nouveaux dérivés du dioxane », C. r. séances Soc. biol. fil., vol. 113, , p. 388 (résumé).
- « Recherches sur l'action sympathicolytique d’un nouveau dérivé du dioxane », Arch. int. pharmacodyn. ther., vol. 46, , p. 178-191 (ISSN 0003-9780, résumé).
- « Action protectrice des éthers phénoliques au cours de l'intoxication histaminique », C. r. séances Soc. biol. fil., vol. 124, , p. 547-549.
- « Action de la thymoxyéthyldiéthylamine (929 F) et des éthers phénoliques sur le choc anaphylactique du cobaye », C. r. Soc. biol., vol. 125, , p. 818-823.
- Anne-Marie Staub, Recherches sur quelques bases synthétiques antagonistes de l’histamine (thèse présentée pour obtenir le grade de docteur en sciences naturelles (série A. 1898, n° 2765)), Paris, université de Paris, faculté des sciences, , 87 p. (OCLC 491498796).
« Sauf erreur, c’est dans sa thèse que figure le mot « antihistaminique » pour la première fois, le mot « histaminolytique » ayant été antérieurement utilisé par Bovet et Mlle Staub. » Marcel Delépine, Ernest Fourneau (1872-1949) : Sa vie, son œuvre, Masson et Cie, 1949, p. 71. - (en) « Dérivés de la N-phényléthylènediamine », Bull. Soc. chim. Fr., vol. 14, nos 9-10, , p. 827-838.
- (en) Charles H. Tilford, Robert S. Shelton et Marcus G. van Campen jeune, « Histamine Antagonists : Basically Substituted Pyridine Derivatives », Journal of the American Chemical Society, vol. 70, , p. 4001-4009 (DOI 10.1021/ja01192a010).
