Diossano
| Diossano | |
|---|---|
| Nome IUPAC | |
| 1,4-diossano | |
| Nomi alternativi | |
| p-diossano dietilendiossido | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H8O2 |
| Massa molecolare (u) | 88,11 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 204-661-8 |
| PubChem | 31275 |
| DrugBank | DBDB03316 |
| SMILES | C1COCCO1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,03375 |
| Indice di rifrazione | 1,422 |
| Solubilità in acqua | miscibile |
| Temperatura di fusione | 12 °C (285 K) |
| Temperatura di ebollizione | 101 °C (374 K) (1013 hPa) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −354 |
| ΔcombH0 (kJ·mol−1) | −2.363 |
| Indicazioni di sicurezza | |
| Punto di fiamma | 11 °C (284 K) (vaso chiuso) |
| Limiti di esplosione | 1,7 - 25,2 vol% |
| Temperatura di autoignizione | 180 °C (453 K) |
| TLV (ppm) | TWA 36 mg/m³ |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 225 - 351 - 319 - 335 - EUH019 - EUH066 |
| Consigli P | 210 - 233 - 281 - 308+313 - 305+351+338 - 403+235 [1] |
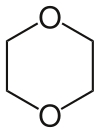
Il diossano (a volte riportato anche come p-diossano o dietilendiossido) � un composto organico eterociclico, un dietere formato da un anello esaatomico con quattro atomi di carbonio e due di ossigeno in posizioni opposte (1,4).
Facilmente infiammabile, irritante e nocivo, a temperatura ambiente si presenta come un liquido incolore, volatile, igroscopico, dal tenue odore etereo gradevole[2]. � solubile in acqua in ogni proporzione e molto usato come solvente, propriet� che condivide con l'altro solvente etereo molto usato, il tetraidrofurano (THF).[3]
Isomeri e conformazioni
[modifica | modifica wikitesto]
Parlando di diossano normalmente si intende l'isomero 1,4-diossano, di gran lunga il pi� diffuso dei tre isomeri ed ampiamente utilizzato come solvente aprotico. Gli altri isomeri sono l'1,2-diossano, strutturalmente un endoperossido, e l'1,3-diossano (numero CAS 505-22-6), un acetale ciclico derivato dalla formaldeide.
Il 1,4-diossano non va confuso con la 1,4-diossina. Pur avendo anch'essa due gruppi eterei � un analogo deidrogenato ma anche stericamente � un composto diverso; la diossina � pressoch� planare mentre il diossano, analogamente al cicloesano, esiste nella conformazione a sedia e in quella a barca.
A temperatura ambiente le due forme, sedia (preferita) e barca, coesistono nel liquido: che sia presente anche quest'ultima forma � evidenziato dal momento dipolare non nullo,[4] pari a 0,45 D (per il tetraidropirano, anello analogo con un solo atomo di ossigeno � 1,74 D).[5][6]
Miscibilit�
[modifica | modifica wikitesto]� miscibile in ogni proporzione con acqua, metanolo, etanolo, dietiletere, acetone, benzene, tetracloruro di carbonio, n-eptano[7] ed � solubile nella quasi totalit� dei solventi organici.[3][8]
Azeotropi
[modifica | modifica wikitesto]Sono noti gli azeotropi in miscela con l'acqua (diossano 81,6%) con punto di ebollizione 87,8 �C e con l'alcol (diossano 9,3%) con punto di ebollizione 73,13 �C.[7]
Sintesi
[modifica | modifica wikitesto]Il diossano si produce industrialmente con acido solforico e glicol etilenico a 150-160 �C, oppure con soluzioni acquose di idrossido di sodio e cloroetilglicole a 100 �C. Dopo disidratazione e rettifica si ottiene un prodotto puro al 98-99%, che pu� essere ulteriormente purificato per congelamento.[7]
Il diossano si sintetizza anche a partire da ossido di etilene.
Nella sintesi del sodio lauriletere solfato (SLES), un tensioattivo ottenuto per solfatazione di un alcol polietossilato, si pu� formare come sottoprodotto non desiderato del diossano. L'uso di questo tensioattivo nella formulazione di shampoo � fonte di polemiche proprio per la possibile presenza[9] del diossano, sostanza sospetta[10][11] cancerogena[12].
Usi
[modifica | modifica wikitesto]Il principale utilizzo � come solvente in molti prodotti come coloranti solubili in oli, colori per legno e cere, vernici, lucidanti (polish), adesivi, lucido da scarpe.
La sua capacit� di sciogliere alcuni sali inorganici ne permette l'uso in reazioni organiche in soluzione. � utilizzato quindi nella produzione di tensioattivi, smacchiatori a secco e svernicianti.
Nell'industria farmaceutica trova impiego come solvente estrattivo e nell'industria tessile nella stampa dei tessuti e come disperdente nei bagni di tintura. I composti clorurati sono impiegati come insetticidi.[7]
Sicurezza
[modifica | modifica wikitesto]I vapori di diossano formano miscele esplosive con l'aria. In presenza di luce e ossigeno si formano dei perossidi che, essendo poco volatili, si concentrano durante la distillazione del diossano e potrebbero esplodere violentemente.
Il diossano � un irritante per gli occhi e le vie respiratorie, � sospettato di causare danni al sistema nervoso centrale e provocare danni renali. � un sospetto cancerogeno.
Note
[modifica | modifica wikitesto]- ^ scheda dell'1,4-diossano su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ (EN) PubChem, Dioxane, su pubchem.ncbi.nlm.nih.gov. URL consultato il 6 giugno 2021.
- ^ a b B.S. Furniss, A.J. Hannaford, P.W.G. Smith e A.R. Tatchell, VOGEL's PRACTICAL ORGANIC CHEMISTRY, 5ª ed., Longman Scientific & Technical, 1989, p. 407, ISBN 0-582-46236-3.
- ^ Solo la forma a barca ha un momento dipolare.
- ^ dioxane, su stenutz.eu. URL consultato il 6 giugno 2021.
- ^ oxane, su stenutz.eu. URL consultato il 6 giugno 2021.
- ^ a b c d Vittorio Villavecchia, Gino Eigenmann, Nuovo dizionario di merceologia e chimica applicata - Vol 3° Cobalto (sali di) - Fisetina, Milano, Hoepli, 1974, ISBN 88-203-0530-5.
- ^ Solvent Miscibility Table, su sigmaaldrich.com. URL consultato il 6 giugno 2021.
- ^ Black RE, Hurley FJ, Havery DC, Occurrence of 1,4-dioxane in cosmetic raw materials and finished cosmetic products, in Journal of AOAC International, vol. 84, n. 3, 2001, pp. 666–70, PMID 11417628.
- ^ 1,4-Dioxane cancer 123-91-1 January 1988 (PDF), su oehha.org, Office of Environmental Health Hazard Assessment.
- ^ California Files Prop 65 Lawsuit Against Whole Foods, Avalon, in Bloomberg.
- ^ Hubert Bosch, Come si riconosce un cosmetico naturale?, su aamterranuova.it, 17 novembre 2005. URL consultato il 20 luglio 2007.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su diossano
Wikimedia Commons contiene immagini o altri file su diossano