Buforowość gleb
Buforowość gleby – zdolność do utrzymywania stałego pH gleby (odczynu), konsekwencja działania różnych roztworów buforowych (przede wszystkim buforu wodorowęglanowego) i buforów wymiany jonowej (sorpcja jonów H+
przez glebowe kompleksy sorpcyjne)[1]. Duże znaczenie ma również buforowość związana z procesami biodegradacji biomasy (detrytusu), opisana dotychczas mniej dokładnie[2][3].
Pojęcie „buforowanie gleb” bywa niekiedy stosowane jako określenie wszystkich procesów zachodzących w ekosystemie glebowym, odpowiedzialnych za utrzymywanie równowagi ekologicznej, w tym przeciwdziałających zmianom składu roztworu glebowego (np. zmianom stężenia innych kationów w czasie nawożenia)[4]
Bufory słaby kwas–sól i słaba zasada–sól
[edytuj | edytuj kod]Działanie buforów najczęściej jest ilustrowane przykładem roztworu zawierającego słaby kwas (zgodnie z teorią Brønsteda – donor H+
) i silną zasadę (akceptor H+
):
- HA(aq) + H
2O ⇌ H
3O+
(aq) + A−
(aq) - XA ⇌ X+
(aq) + A−
(aq)
Po częściowej dysocjacji składników układu ustala się równowaga silnie przesunięta w stronę kwasu (HA) – dobrze zdysocjowana sól blokuje dysocjację słabego kwasu. Wartość pH w stanie równowagi zależy od stałej dysocjacji kwasu (Ka) oraz od stężeń molowych donora i akceptora (równanie Hendersona-Hasselbalcha):
Poziom pH utrzymuje się dopóty, dopóki nie zostanie przekroczona pojemność buforowa, zależna od stałej równowagi reakcji buforowej i od stężenia czynnika słabo dysocjującego.
Bufor wodorowęglanowy
[edytuj | edytuj kod]W buforze wodorowęglanowym donorem (protonodawcą) jest kwas węglowy (H
2CO
3), a akceptorem (protonobiorcą) anion HCO−
3). Podstawowe znaczenie mają reakcje rozpuszczania wapieni (CaCO
3). Od szybkości tego procesu zależy szybkość buforowania[2].
W czasie dodawania mocnych kwasów i zasad zachodzą np. reakcje:
- HCO−
3 + H
3O+
⇌ H
2CO
3 + H
2O - H
2CO
3 + OH−
⇌ HCO−
3 + H
2O
- HCO−
Charakterystyka według Ullmana (1981, 1983)[2]:
- zakres buforowania: pH = 6,2–8,0,
- pojemność buforowa górnej warstwy gleby (miąższość 1 dm) o gęstości objętościowej 1,5 g/cm³ i powierzchni 1 ha:
- – 150 kmol H+
· % CaCO
3 (buforowanie kwasu węglowego), - – 300 kmol H+
· % CaCO
3 (buforowanie silnych kwasów).
Bufor krzemianowy
[edytuj | edytuj kod]Buforowanie z udziałem krzemianów jest złożonym procesem wieloetapowym, w którym wiązanie H+
zachodzi m.in. w czasie wietrzenia glinokrzemianów (np. anortyt, kaolinit) z uwolnieniem kationów zasadowych lub adsorpcji kationów w powstających materiałach ilastych. Końcowymi produktami procesu są tlenki Al, Fe i Mn i niezdysocjowane kwasy krzemowe.
Charakterystyka według Ullmana (1981, 1983)[2]:
- zakres buforowania: pH = 5,0–6,2,
- pojemność buforowa górnej warstwy gleby (miąższość 1 dm) o gęstości objętościowej 1,5 g/cm³ i powierzchni 1 ha:
- – przeciętnie 75 kmol H+
· % krzemianów.
Bufor glinowy
[edytuj | edytuj kod]Działanie buforu glinowego jest ilustrowane równaniem:
- AlOOH + 3H+
= Al3+
+ 2H
2O
- AlOOH + 3H+
w którym AlOOH oznacza odpowiednie fragmenty minerałów ilastych lub uwodnione tlenki Al. Buforowanie wiąże się z obecnością toksycznego dla roślin jonu Al3+
w roztworze glebowym.
Charakterystyka według Ullmana (1981, 1983)[2]:
- zakres buforowania: pH = 2,8–4,2,
- pojemność buforowa górnej warstwy gleby (miąższość 1 dm) o gęstości objętościowej 1,5 g/cm³ i powierzchni 1 ha:
- – przeciętnie 100–150 kmol H+
· % frakcji ilastej.
Bufor żelazowy
[edytuj | edytuj kod]Działanie buforu żelazowego jest ilustrowane równaniem charakteryzującym wybielanie gleby:
- FeOOH + 3H+
= Al3+
+ 2H
2O
- FeOOH + 3H+
w którym FeOOH oznacza odpowiednie fragmenty sieci tlenków i wodorotlenków Fe.
Charakterystyka według Ullmana (1981, 1983)[2]:
- zakres buforowania: pH = 2,4–3,8,
- pojemność buforowa górnej warstwy gleby (miąższość 1 dm) o gęstości objętościowej 1,5 g/cm³ i powierzchni 1 ha:
- – przeciętnie 270 kmol H+
· % Fed (wolne tlenki, ulegające ekstrakcji z zastosowaniem Na
2S
2O
4).
Bufor wymiany jonowej (sorpcyjny)
[edytuj | edytuj kod]Bufory sorpcyjne tworzą bardzo zróżnicowane stałe cząstki kompleksu sorpcyjnego[3][5]:
- cząstki mineralne wysycone zasadami,
- cząstki próchnicy glebowej, pełniące w buforach rolę słabych kwasów organicznych.
Na powierzchni wysyconych zasadami cząstek mineralnych zachodzą pod wpływem kwasów różne procesy wymiany jonów, np. wymiany Ca2+
i Mg2+
na równoważną liczbę jonów H+
, a pod wpływem zasad – wymiana jonów H+
na inne kationy[2][5].
Charakterystyka według Ullmana (1981, 1983)[2]:
- zakres buforowania: pH = 4,2–5,0,
- pojemność buforowa gleby zależna od PWK i stopnia wysycenia sorbentu zasadami.
Czynniki ekologiczne
[edytuj | edytuj kod]
lub kationów zasadowych. Stabilność pH gleby jest konsekwencją równowagi ekologicznej, obejmującej procesy tworzące wszystkie cykle biogeochemiczne, w tym m.in. chemiczne, biologiczne i mechaniczne wietrzenie skały macierzystej, umożliwiające uzupełnianie zasobów jonów zasadowych w obiegu
Poza zmierzającymi do równowagi termodynamicznej reakcjami chemicznymi i procesami fizykochemicznymi w każdej glebie zachodzą procesy biologiczne. Biorą w nich udział liczne organizmy – producenci, konsumenci, reducenci) – uczestniczące w obiegu wody i biogennych pierwiastków w ekosystemie. Częścią ekosystemu, jakim jest np. naturalny las jest gleba, charakteryzująca się określonym profilem. Jest on układem genetycznych poziomów, który ukształtował się w długotrwałym procesie sukcesji ekologicznej, prowadzącym do stanu równowagi ekologicznej. Na określonym podłożu mineralnym w ustalonych warunkach klimatycznych powstaje odpowiadająca tym warunkom biocenoza i charakterystyczna gleba, z wartościami pH charakterystycznymi dla poszczególnych poziomów. Skuteczne działanie tak rozumianego buforu ekologicznego wymaga długiego czasu. W ekosystemach przekształconych przez człowieka, np. agrocenozach, utrzymanie właściwych wartości pH powinny umożliwiać odpowiednie zabiegi agrotechniczne[6][7].
Badania właściwości buforowych
[edytuj | edytuj kod]W praktyce laboratoryjnej lub w czasie badań terenowych stosuje się wiele różnych metod pomiarów, dostosowanych do konkretnych zadań badawczych. Metodą bardzo popularną jest wyznaczanie kształtu „krzywych buforowych” – zależności pH-metrycznie wyznaczanego odczynu od ilości odczynnika – roztworu kwasu lub zasady – dodanego do badanej próbki. Różnica między klasycznym miareczkowaniem potencjometrycznym i rejestracją krzywych buforowych dotyczy przede wszystkim czasu trwania oznaczenia. W przypadku badania gleb trzeba uwzględnić czas osiągania stałej wartości pH po dodaniu porcji kwasu lub zasady (czas między wprowadzaniem kolejnych porcji odczynnika wynosi niekiedy > 1 godz). Stosuje się np. procedurę polegającą na równoczesnym dodawaniu różnych porcji odczynników do serii badanych próbek, a następnie – po upływie czasu niezbędnego do ustalenia się równowagi (zwykle 24 godz) – oznaczeniach pH całej serii roztworów[2][5].
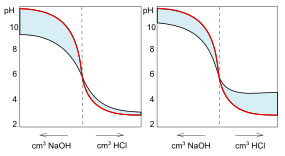
Porównywanie zdolności buforowania różnych gleb wykonuje się m.in. metodą Arreheniusa. W czasie badań działaniu odczynników o różnym składzie (kwasów i zasad) poddaje się próbki ocenianych gleb i próbki wzorcowe – np. nie zawierający kompleksu sorpcyjnego piasek kwarcowy. Sporządzane są wykresy zależności pH roztworów (próbki pobrane znad badanej gleby i piasku) od ilości dodanego kwasu lub zasady. Powierzchnie zawarte między oboma wykresami są nazywane powierzchniami buforowania. Mała powierzchnia buforowania kwasów występuje np. w przypadku gleb bezwęglanowych; w takich glebach może występować próchnica, zapewniająca duże zdolności buforowe w zakresie zasadowym. Dużą powierzchnią buforowania w obu zakresach (zasadowym i kwaśnym) charakteryzują się gleby zasobne w sorbenty próchnicze i mineralne[2].
Przypisy
[edytuj | edytuj kod]- ↑ Buforowość gleby. [w:] Ekologia.pl – Polski Portal Ekologiczny [on-line]. [dostęp 2012-06-12]. (pol.).
- ↑ a b c d e f g h i j Renata Bednarek, Helena Dziadowiec, Urszula Pokojska, Zbigniew Prusinkiewicz: Badania ekologiczno-gleboznawcze. Warszawa: Wydawnictwo Naukowe PWN, 2004, s. 198–221. ISBN 83-01-14216-2.
- ↑ a b Mariusz Fotyma, Stanisław Mercik: Chemia rolna. Warszawa: Wydawnictwo Naukowe PWN, 1992, s. 38–45.
- ↑ Mariusz Fotyma, Stanisław Mercik, Antoni Faber: Chemiczne podstawy żyzności gleb i nawożenia. Warszawa: PWRiL, 1987.
- ↑ a b c Mieczysław Koter: Chemia rolna. Warszawa: Państwowe Wydawnictwo Naukowe, 1976, s. 187–191.
- ↑ Środowisko naturalne. W: Tadeusz Stefanowicz: Wstęp do ekologii i podstaw ochrony środowiska. Poznań: 199, s. 126 141. ISBN 83-7143-066-3.
- ↑ Anna Kalinowska: Ekologia – wybór przyszłości. Warszawa: Editions Spotkania. ISBN 83-7115-027-X.