Acid hydroiodic
| Acid hydroiodic | |||
|---|---|---|---|
| |||
| |||
| Danh pháp IUPAC | Iodane[1] | ||
| Tên khác | Hydroni iodide | ||
| Nhận dạng | |||
| Số CAS | |||
| PubChem | |||
| Số EINECS | |||
| ChEBI | |||
| Số RTECS | MW3760000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| InChI | đầy đủ
| ||
| UNII | |||
| Thuộc tính | |||
| Công thức phân tử | HI(aq) | ||
| Khối lượng mol | 127.91 g/mol | ||
| Bề ngoài | Dung dịch không màu | ||
| Mùi | Chát | ||
| Khối lượng riêng | 1.70 g/mL, hỗn hợp đẳng phí (57% HI theo khối lượng) | ||
| Điểm nóng chảy | |||
| Điểm sôi | 127 °C (400 K; 261 °F) 1.03 bar, hỗn hợp đẳng phí | ||
| Độ hòa tan trong nước | Dung dịch nước | ||
| Độ axit (pKa) | -9.3 | ||
| Các nguy hiểm | |||
| Phân loại của EU | Ăn mòn (C) | ||
| NFPA 704 |
| ||
| Chỉ dẫn R | R34 | ||
| Chỉ dẫn S | (S1/2), S26, S45 | ||
| Điểm bắt lửa | Không bắt lửa | ||
| Các hợp chất liên quan | |||
| Anion khác | Acid hydrofluoric Acid hydrochloric Acid hydrobromic | ||
| Hợp chất liên quan | Hydro iodide | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Acid hydroiodic (hoặc acid hydriodic) là một acid tạo thành khi hydro iodide hòa tan trong nước. Hợp chất này có công thức hóa học là HI. Nó là một acid mạnh và bị điện li hoàn toàn trong dung dịch nước. Dung dịch HI là một dung dịch không màu. Dung dịch đậm đặc của acid hydriodic thường chứa 48% - 57% HI.[2]
Tính chất
[sửa | sửa mã nguồn]Acid hydroiodic bị oxy hoá dần bởi oxy trong không khí, sinh ra iod:

Giống như các acid hydrohalogenic khác, acid hydroiodic tham gia phản ứng cộng với anken để tạo ra ankyl iodide. Nó cũng có thể được sử dụng như một chất khử, ví dụ trong quá trình khử các hợp chất nitro thơm thành anilin.[3]
Tính acid mạnh
[sửa | sửa mã nguồn]Acid hydroiodic là dung dịch hoà tan của khí hydro iodide trong nước. Dung dịch HI bão hòa thường có nồng độ 48% - 57%. HI có tính acid mạnh, do sự phân tán của điện tích ion trên các anion. Ion iod lớn hơn nhiều so với các ion của halogen phổ biến khác. Vì vậy, điện tích âm được phân tán trên một không gian lớn. Ngược lại, ion chlor nhỏ hơn nhiều, có nghĩa là điện tích âm của nó tập trung lại nhiều hơn, dẫn đến một sự tương tác mạnh mẽ hơn giữa proton và ion chlor. Sự tương tác H+---I− yếu tạo điều kiện cho sự phân ly của proton từ anion, vì vậy, HI là acid mạnh nhất trong các acid hydrohalogenic.
HI(g) + H2O(l) → H3O(aq)+ + I-(aq) Ka≈ 1010
HBr(g) + H2O(l) → H3O(aq)+ + Br-(aq) Ka≈ 109
HCl(g) + H2O(l) → H3O(aq)+ + Cl-(aq) Ka≈ 108
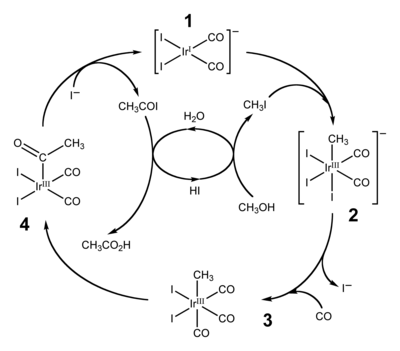
Quá trình Cativa
[sửa | sửa mã nguồn]Quá trình Cativa là quá trình sử dụng cuối cùng chính của acid hydroiodic, đóng vai trò như một chất đồng xúc tác để sản xuất acid acetic bằng cách cacbonyl hóa methanol.[4][5]
Sử dụng bất hợp pháp
[sửa | sửa mã nguồn]Acid hydroiodic được liệt kê là Hóa chất DEA Danh sách I của Liên bang Hoa Kỳ, do được sử dụng như một chất khử liên quan đến việc sản xuất methamphetamine từ ephedrine hoặc pseudoephedrine (thu hồi từ thuốc thông mũi).[6]
Chú thích
[sửa | sửa mã nguồn]- ^ Henri A. Favre; Warren H. Powell biên tập (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Cambridge: The Royal Society of Chemistry. tr. 131.
- ^ Lyday, Phyllis A. “Iodine and Iodine Compounds”. Bách khoa toàn thư Ullmann về Hóa chất công nghiệp. Weinheim: Wiley-VCH. tr. 382–390. doi:10.1002/14356007.a14_381.
- ^ Kumar, J. S. Dileep; Ho, ManKit M.; Toyokuni, Tatsushi (2001). “Simple and chemoselective reduction of aromatic nitro compounds to aromatic amines: reduction with hydriodic acid revisited”. Tetrahedron Letters. 42 (33): 5601–5603. doi:10.1016/s0040-4039(01)01083-8.
- ^ Jones, J. H. (2000). “The Cativa Process for the Manufacture of Acetic Acid” (PDF). Platinum Metals Rev. 44 (3): 94–105. Bản gốc (PDF) lưu trữ ngày 24 tháng 9 năm 2015. Truy cập ngày 13 tháng 9 năm 2021.
- ^ Sunley, G. J.; Watson, D. J. (2000). “High productivity methanol carbonylation catalysis using iridium - The Cativa process for the manufacture of acetic acid”. Catalysis Today. 58 (4): 293–307. doi:10.1016/S0920-5861(00)00263-7.
- ^ Skinner, Harry F. "Methamphetamine Synthesis via HI/Red Phosphorus Reduction of Ephedrine".






